近日,上海大学医学院博士研究生汪楠以第一作者在Angewandte Chemie-International Edition上发表了题为“Tyrosinase-Catalyzed Peptide Stapling Using Para-Amino Phenylalanine and Tyrosine Anchoring Residues”的研究论文。根据最新发布的SCI影响因子(IF),该杂志的IF为16.1,是中科院期刊分区大类化学1区TOP期刊。该研究首次利用酪氨酸酶实现了高效、绿色的多肽订书化技术。
上海大学医学院为论文的第一完成单位。海军军医大学徐正阳和上海大学医学院博士研究生沈华星为论文的共同第一作者,上海大学医学院胡宏岗教授,海军军医大学李翔副教授为论文的共同通讯作者。
多肽的大环化订书修饰通常涉及重金属催化剂和有机溶剂的大量使用,在一定程度上限制了该类分子进一步的药物开发。研究团队受酪氨酸酶氧化机制启发,设计了一种对氨基苯丙氨酸(Z)与酪氨酸(Y)侧链交联的新方法。首先对反应条件进行了系统优化筛选,主要包括反应温度、pH 值和酪氨酸酶的用量,从而确定了最适合的反应条件(图1)。
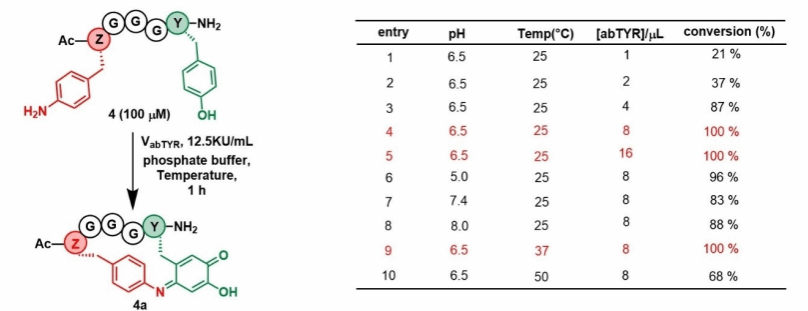
图1酪氨酸酶催化Z-Y偶联的反应条件优化
研究团队通过优化反应条件,发现Z-Y偶联产物比Y-Z产物更稳定,且具有更高的产率。此外,该方法成功应用于多种生物活性肽修饰,包括雌激素受体(ER)、MC4和GPR54多肽,与线性肽相比,显著提升了多肽的稳定性和生物活性(图2)。该技术突破了传统多肽订书化的局限性,为开发高稳定性、高活性的肽类药物提供了全新工具。
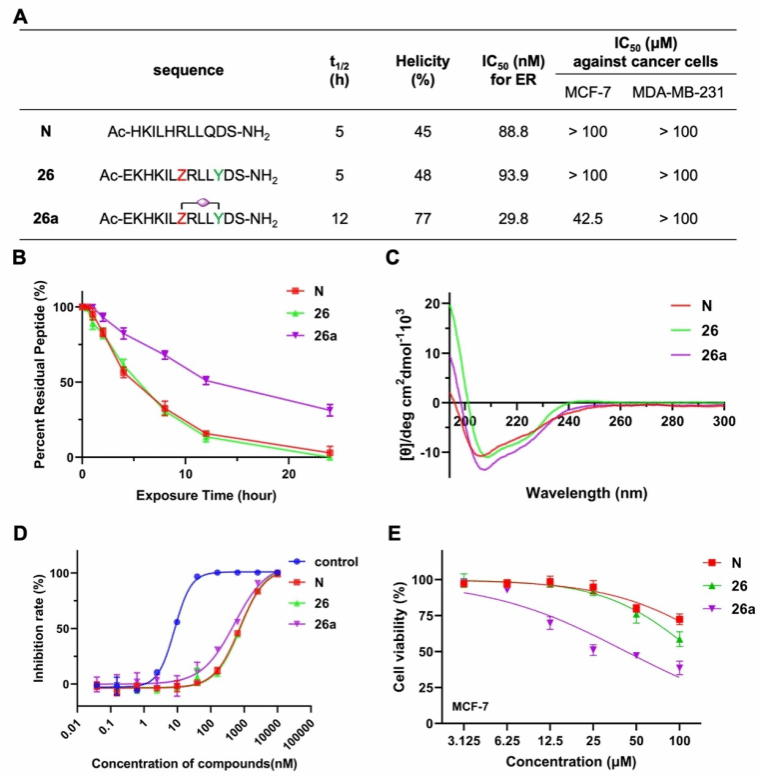
图2 ER订书肽的相关表征
论文链接:
https://onlinelibrary.wiley.com/doi/full/10.1002/anie.202420522




