2024年8月27日,上海大学医学院卞月珉教授与美国哈佛大学医学院Jonathan Abraham教授团队合作,作为共同第一作者,在国际顶级期刊《Cell》上发表题为Viral DNA polymerase structures reveal mechanisms of antiviral drug resistance的研究论文。论文链接:https://doi.org/10.1016/j.cell.2024.07.048

DNA 聚合酶是一类重要的药物靶标,系列结构研究捕捉到了其构象的多样性。然而,对于聚合酶的动态构象对药物抗性的影响,仍是困扰人们的一大问题。核苷类似物阿昔洛韦、以及焦磷酸类似物膦甲酸钠靶向作用于单纯疱疹病毒(herpes simplex virus, HSV)聚合酶。对于这两种抗病毒药物,聚合酶(UL30或Pol)的催化亚基中多个位置的突变可以导致临床耐药。突变与耐药性的产生;阿昔洛韦以及膦甲酸钠对HSV Pol的选择性,目前二者机理均不明确。
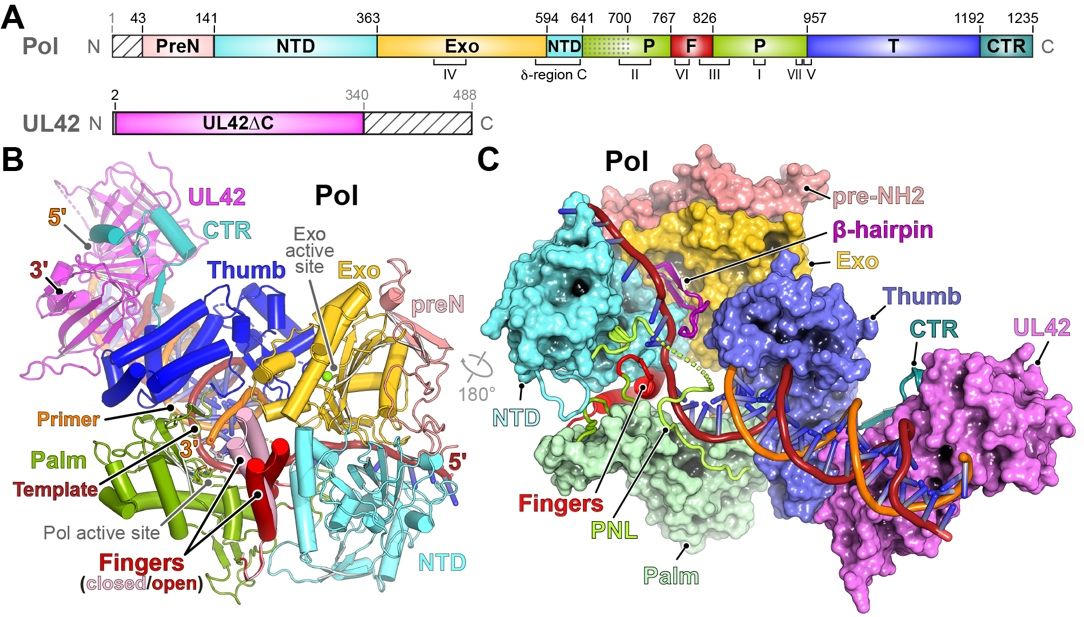
该研究首次揭示了多种构象下与DNA结合的单纯疱疹病毒聚合酶全酶(DNA-bound herpes simplex virus polymerase holoenzyme),以及其与临床使用的抗病毒药物的相互作用。HSV聚合酶是由Pol和一个促进长链DNA合成的过程性亚基(UL42)组成的异二聚体。HSV Pol具有典型的拇指、手掌和手指域,3'-5'外切酶域(Exo),以及NH2末端域(NTD),UL42作为单体紧密结合DNA。
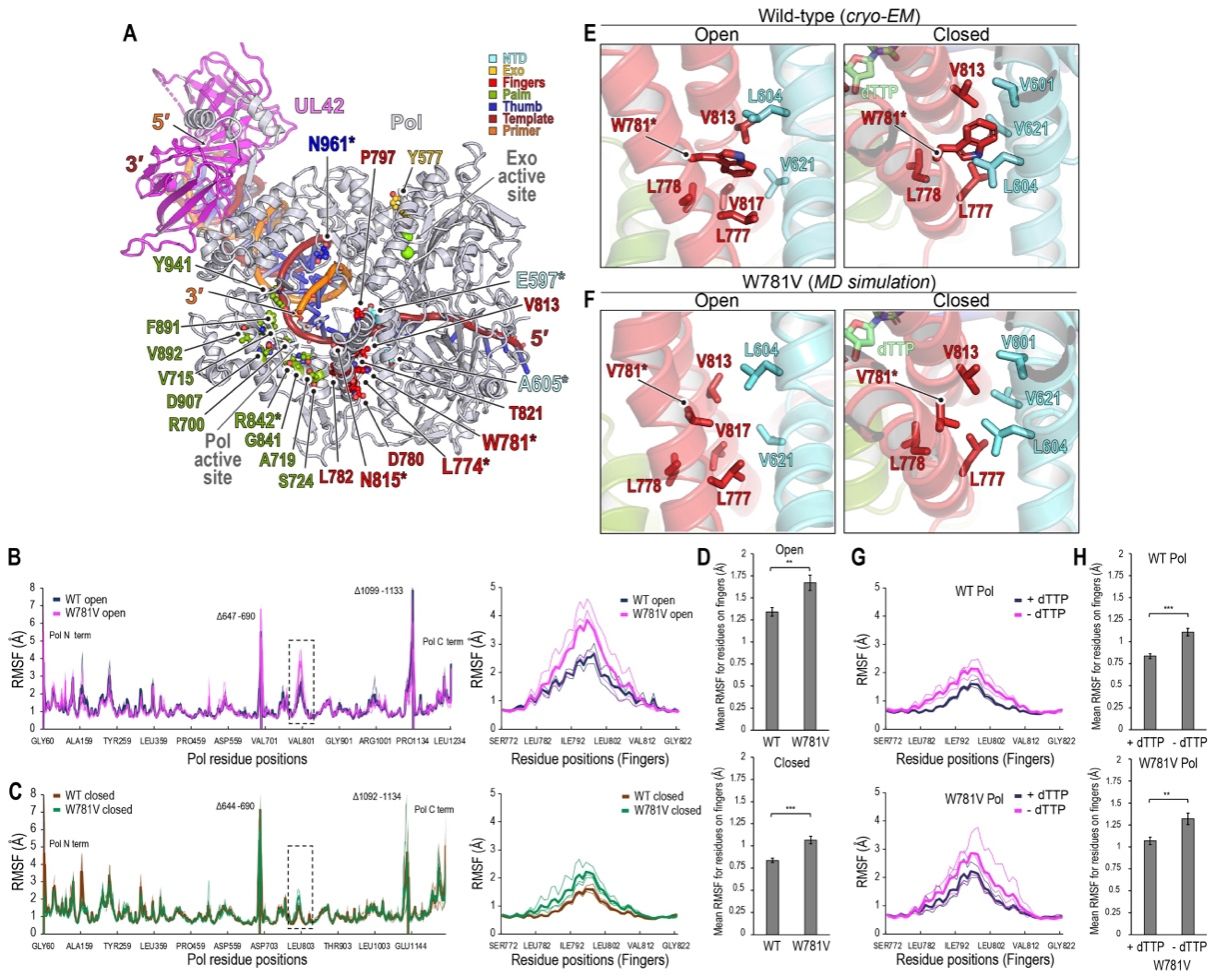
相关工作直观展示了催化亚基Pol和过程因子UL42如何结合DNA以促进持续的DNA合成。值得指出的是,在没有引入核苷酸的情况下,Pol处于多种构象中,手指域处于闭合状态;而与药物结合的结构揭示了抗病毒药物对处于闭合构象聚合酶的亲和力与选择性。此外,分子动力学模拟和抗药性突变体的冷冻电子显微镜结构表明,相关抗性突变是通过调节构象动态以实现对药-靶相互作用的阻碍,而不是直接影响药物结合,从而阐明了导致药物选择性的机制。

卞月珉,教授,博士生导师,上海市海外高层次人才。本科毕业于中国药科大学,博士毕业于美国匹兹堡大学。曾担任资深计算科学家职位,就职于美国麻省理工和哈佛大学布罗德研究所从事新药研发工作,2024年3月全职加入上海大学医学院。长期致力于人工智能药物发现相关研究,通过开发并整合机器学习与深度学习算法,计算化学与计算生物学策略手段,加速临床前早期药物发现。担任英国国家研究与创新署UKRI、智利国家研究与发展署ANID等机构基金评审外籍专家。近五年,代表性成果分别发表于Nature, Cell等顶级学术期刊。




