近日,上海大学医学院张天龙研究员在生命科学权威期刊《Molecular Cell》(中科院一区,影响因子16.6)发表了题为“CASTOR1 and CASTOR2 respond to different arginine levels to regulate mTORC1 activity”的研究成果,该研究系统揭示了CASTOR1与CASTOR2作为高等真核生物特有的精氨酸感应蛋白,通过差异化响应细胞内不同精氨酸浓度,调控GATOR2复合物功能及mTORC1活性,进而影响肌肉生长与分化,为肌肉萎缩、肿瘤等疾病的精准干预提供了新的理论依据与潜在靶点。

mTORC1信号通路是真核生物中高度保守的营养感知核心,能够整合营养(尤其是氨基酸)与能量(ATP)供应状态,实时调控细胞合成代谢与分解代谢的动态平衡。该通路异常与衰老、糖尿病、肥胖及肿瘤等多种重大疾病的发生发展密切相关。尽管已知mTORC1活性受多种氨基酸调控,但细胞如何在氨基酸浓度波动下实现对mTORC1“动态、精细”响应,仍是领域内尚未解决的关键科学问题。
在前期研究中,团队解析了精氨酸感应蛋白CASTOR1-精氨酸复合物的晶体结构(Cell Discov., 2016),发现CASTOR1对精氨酸具有高亲和力(Kd ≈ 5 μM),远低于正常生理条件下细胞中精氨酸浓度,提示细胞需要依赖额外的感应机制以实现对精氨酸的梯度响应。该研究中,团队进一步聚焦CASTOR1的同源蛋白CASTOR2。CASTOR2早期被认为不具备精氨酸结合能力,仅作为mTORC1的组成型负调控因子发挥功能。该研究通过生化功能分析和复合物结构测定发现,CASTOR2同样可结合精氨酸,其亲和力显著低于CASTOR1(Kd ≈ 215 μM),提示其在高浓度精氨酸条件下发挥调控作用。机制上,CASTOR1与CASTOR2均可与GATOR2核心组分Mios直接结合,阻断GATOR2与GATOR1的相互作用,从而抑制mTORC1活性。不同浓度的精氨酸通过调控CASTOR1/2与Mios的结合强度,实现对GATOR1活性的梯度调控,进而精细调节mTORC1活性。研究进一步发现CASTOR1/2在肌肉组织中高表达,其介导的精氨酸感知机制直接影响肌肉细胞中mTORC1活性及细胞生长与分化过程。
综上,该研究首次提出CASTOR1/2作为“双重传感器”协同作用,分别响应低浓度与高浓度精氨酸,实现对mTORC1活性的分段、梯度调控,突破了传统精氨酸营养信号响应的“开/关式”认知框架,也为理解细胞如何在波动的营养环境中维持代谢稳态提供了新的理论模式,为营养感知、代谢调控及相关疾病干预研究开辟了新的方向。
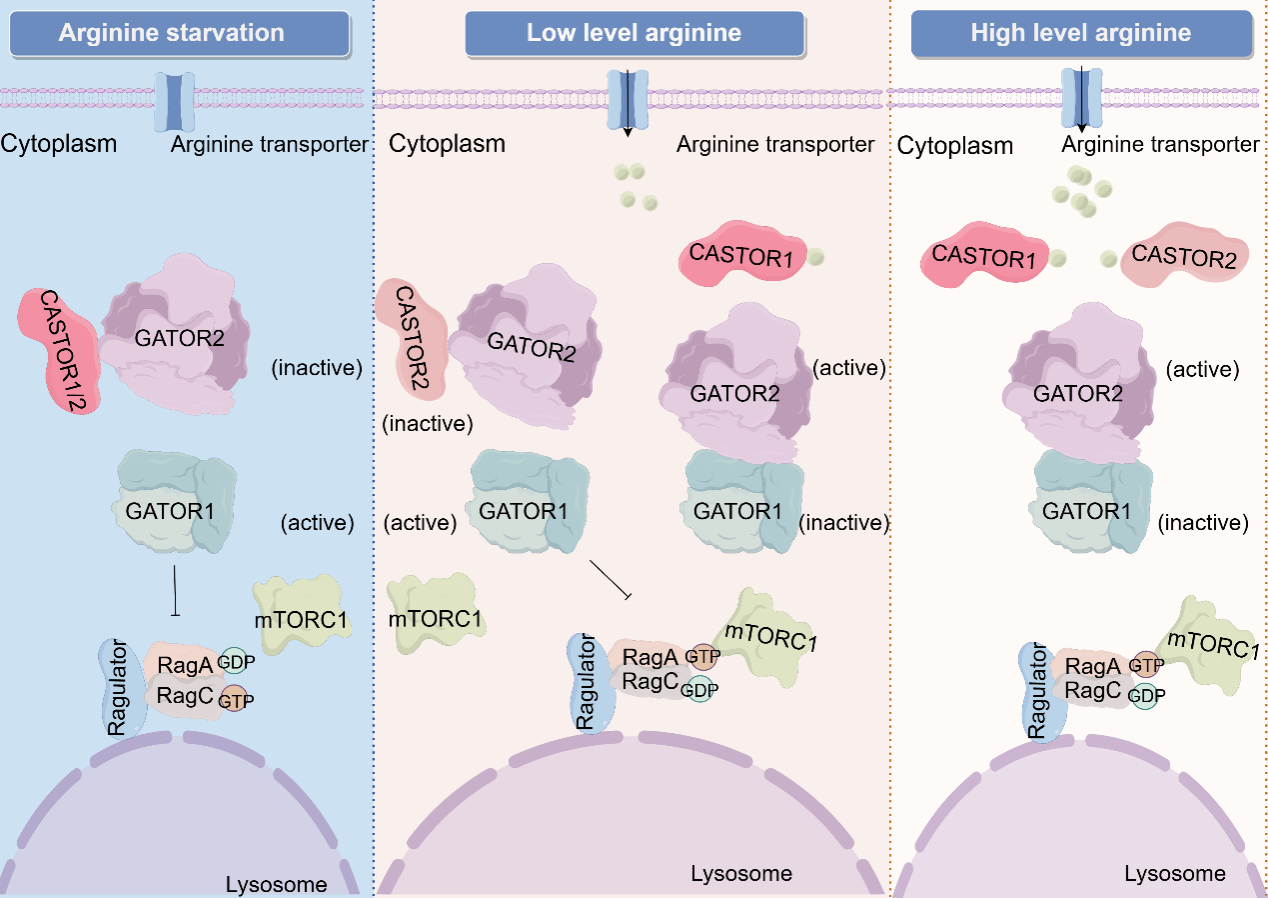
图1. CASTOR1/2的作用机制示意图。当精氨酸缺乏时,CASTOR1和CASTOR2分别结合GATOR2复合物,抑制GATOR2与GATOR1的相互作用,GATOR1发挥GAP活性,抑制下游Rag小G蛋白与mTORC1的相互作用,从而抑制mTORC1活性;当营养充足时,CASTOR1和CASTOR2分别响应低浓度和高浓度的精氨酸,从GATOR2解离,进而GATOR2抑制GATOR1活性,促进mTORC1与Rag小G蛋白结合定位在溶酶体上,激活mTORC1信号通路。
上海大学医学院博士研究生刘婵为该研究的第一作者。上海大学医学院张天龙研究员和中国科学院分子细胞科学卓越创新中心丁建平研究员为论文的共同通讯作者。该研究得到了校内肖俊杰、苏笠教授等团队和北京大学刘颖教授的指导支持。该研究获得科技部重点研发计划、国家自然科学基金、上海大学医学院科技创新基金和跨学科新医科研究生创新基金等项目的资助。
原文链接: https://www.cell.com/molecular-cell/fulltext/S1097-2765(25)01015-9




